GALVANOSTEGIA
DEFINICIONES:

Significa generalmente cubrir electrolíticamente un objeto
con una capa delgada de otro metal, del mismo o de una aleación. El metal se
deposita con fines decorativos, o para proteger el metal recubierto de la
corrosión o de la acción de los agentes atmosféricos u otros. En los últimos
años el campo de la
galvanostegia se ha
extendido también a la reparación de piezas gastadas de máquinas, en cuyo caso
los depósitos deberán ser mucho más gruesos. Se debe distinguir la
galvanostegia de la
galvanoplastia,
que significa recubrir electrolíticamente una superficie no metálica con una
capa metálica.

El primer depósito galvánico parece que fue obtenido por
Brugnatelli, alumno y colaborador de
Volta, allá
Jacobi, un físico ruso a quien su gobierno le había
encargado la construcción de un motor eléctrico, observó que una pila de
Daniell, que empleaba para dicho objeto, no actuaba en
forma correcta. La desarmó y vio que sus láminas de cobre se encontraban
recubiertas de un depósito rugoso que se descamaba fácilmente. Reclamó,
entonces, ante la persona que había construido la pila, diciéndole que le había
vendido un aparato en mal estado, pero ante las protestas del vendedor, examinó
las láminas y vio que debajo del depósito, que había tomado todas las
imperfecciones del metal que le servía de base, se encontraba el cobre en
perfecto estado. Repitió
En
la misma época, Tomás Spencer mostraba en Liverpool planchas grabadas y
medallas perfectamente reproducidas por el mismo proceso.

más tarde la
experiencia, presentando en 1838 ante los miembros de la academia de ciencias
de San Petersburgo los resultados de sus ensayos.
por el año de 1801. Más tarde, en 1837,
Cuando apareció la galvanostegia,
numerosos investigadores buscaron un método para aplicarla al dorado, pues en
las condiciones en que tal operación se hacía antes, no había ninguna seguridad
para el obrero. De la Rive, un profesor de
física de Génova, trató en un principio de depositar el oro del cloruro aúrico,
en 1840, pero no llegó a obtener resultados satisfactorios.
Se creyó entonces que no había modo de hacer tal deposición,
pero en la actualidad, como veremos más adelante, se ha demostrado que todo
consiste en hallar el electrólito adecuado. Ruolz
en Francia y Wright
en Gran Bretaña, encontraron métodos
semejantes para obtener un buen plateado y dorado, a mediados del siglo pasado,
luego de los ensayos de De la Rive. Ruolz
también publico una serie de trabajos sobre recubrimientos con otros metales y
con aleaciones.
En lo que se refiere a depósitos
de hierro, los primeros trabajos datan de 1846, en que Boch, Buschmann y Liet hicieron
ensayos bastante satisfactorios empleando una solución de sulfato ferroso sin
acidez libre. Al año siguiente. Boettger indicó
el uso, como electrólito, de una solución de protóxido de hierro amoniacal.
El proceso de niquelado que se
usa en la actualidad, es una variante del propuesto por Becquerel en 1862 ante la academia de ciencias de
Francia, en el que se empleaba sulfato doble de níquel y amonio. El mismo baño
fue patentado por Adams en Estados Unidos en
1869.
Se han citado algunos métodos que actualmente se siguen en galvanostegia y dejaremos paso a la práctica del
proceso. Haremos un estudio de los
elementos empleados, se darán una serie de definiciones y trataremos separadamente cada operación, indicando algunos
adelantos que se conocen al respecto.
GENERALIDADES
TEORÍA DE LA DISOCIACIÓN ELECTROLÍTICA
Las soluciones acuosas de ácidos, bases y sales, tienen la
propiedad de conducir la corriente eléctrica. Al hacer alguna de estas
soluciones, de por sí algunas moléculas del soluto se disocian, dependiendo
esto de la naturaleza del electrólito y de la concentración de la solución.
ELECTRÓLITO, es la
solución que se va a someter a la disociación electrolítica se llama la
descomposición de una solución del tipo de las indicadas por medio de la
electricidad. Arrhenius fue uno de los primeros
en enunciar sus teorías sobre la electrólisis, en cuyos principios se basa
mucho de lo que en la actualidad se conoce.
Un ejemplo de descomposición lo tenemos al tratar una
solución de sulfato de cobre por medio de la electricidad. Preparamos una
solución de sulfato de cobre (electrólito)
la cual colocamos en una cuba electrolítica. Sumergimos en ella dos electrodos de
platino y abrimos el paso de la corriente. La solución se descompondrá en sus
iones, yendo unos al polo negativo y otros al polo positivo.
Podríamos decir que los iones son átomos con una carga
eléctrica, positiva o negativa, equivalente a su valencia. Los iones que van al
polo negativo de la fuente generadora de corriente eléctrica, el cual recibe el
nombre de cátodo.
Los iones que van al ánodo,
o sea el electrodo conectado al polo positivo, reciben el nombre de aniones y
tienen carga eléctrica negativa.
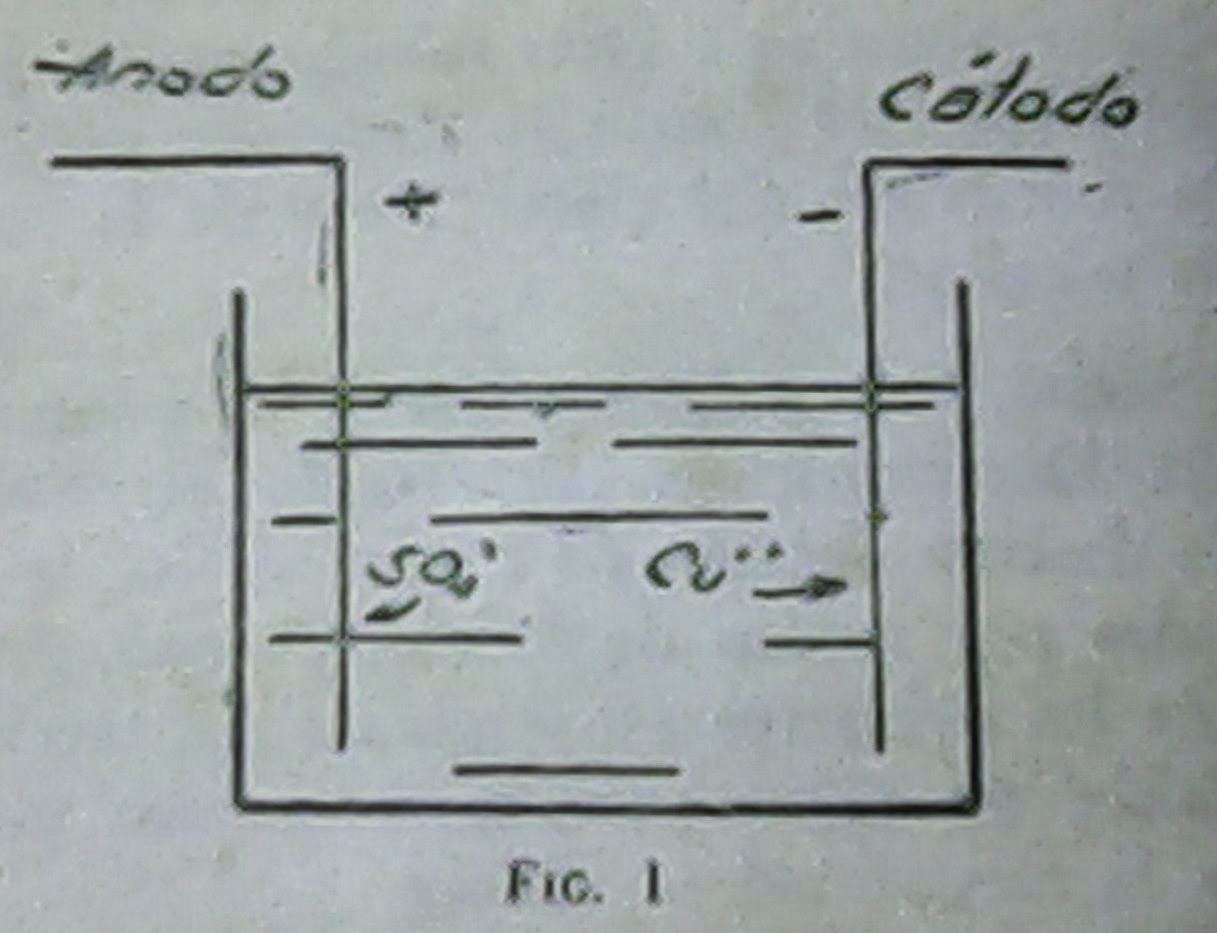
Volviendo a nuestro ejemplo, la solución de sulfato de cobre
se disociará en iones cobre, que indicamos – Cu ++, por actuar el cobre como
bivalente en este caso,e iones sulfato, SO₄--. Como se indica en la
figura (
1), el cobre se dirigiría al
cátodo, fijándose a él, mientras que el radical
sulfato iría al
ánodo, desprendiendo el
oxígeno y enriqueciendo la solución en el ácido sulfúrico, pues se va
disolviendo en ella poco a poco.
Terminada la experiencia veríamos que sobre el cátodo se ha formado una capa de cobre.

La marcha de la corriente eléctrica se puede apreciar
gráficamente en la figura (
2); entra en el
electrólito por
ánodo, y después de
haberlo atravesado sale por el
cátodo. En la
figura las flechas in dican el sentido de la corriente. Al actuar esta
corriente sobre el electrólito, lo descompone, como ya hemos dicho, en dos
partes: una que va hacia el
ánodo y otra que
va
hacia el
cátodo. Una ley fundamental de la electrólisis dice
que lo metales y el hidrogeno marchan en el sentido de la corriente, es decir
que se desprenden en el
cátodo.
el
LEYES DE FARADAY.- La
electrólisis está regida por las leyes de Faraday,
que son las siguientes:
a)
Las porciones de electrólito desprendidas en los
electrodos son directamente proporcionales a la intensidad y a la duración de
la corriente.
b)
Los equivalentes electroquímicos son
directamente proporcionales a los pesos atómicos e inversamente proporcionales
a la valencia de los átomos.
Es decir que la intensidad de la corriente
eléctrica que atraviesa el electrólito tiene importancia básica en la
operación. Sabemos que intensidad de corriente es la cantidad de electricidad
que atraviesa en un segundo una sección transversal de cualquier conductor. La
unidad práctica usada para medir la intensidad es el amperio, que en adelante
abreviaremos así amp. Y que equivale a la intensidad de una corriente eléctrica que
precipita 1,118 mg de plata en un segundo.
Hemos dicho que una corriente eléctrica
tiene dirección, por consiguiente debe haber una fuerza que la impulse. Tal
fuerza recibe el nombre de fuerza electromotriz. Se mide en voltios, que en
adelante abreviaremos volt., siendo el volt. La
tención capaz de producir una corriente de 1 amperio a través de una
resistencia de un ohmio.
El ohmio (Ω)
es la resistencia que opone a la corriente eléctrica un hilillo de mercurio de
1,063m de largo y 1 mm₂ de sección, a 0°C.
La ley de Ohm
relaciona los valores indicados, y dice que la intensidad es inversamente
proporcional a la resistencia, en igualdad de fuerza electromotriz.
Es
decir, que I=E sobre R

, siendo I, la intensidad;
E, la fuerza electromotriz y R la resistencia.
Interpretando
la segunda ley de Faraday, vemos que la cantidad
de metal, depositada en el cátodo por acción de
la corriente eléctrica depende del peso atómico y de su valencia.
Estos son conceptos fundamentales de la
electrólisis. El objetivo de estos próximos artículos es hacer estas prácticas
de galvanostegia accesibles a toda persona, y
quien desee entrar más en materia puede recurrir a cualquier tratado de
electroquímica donde encontrara explicados ampliamente estos conceptos
teóricos.
Para un fin práctico de la electrólisis,
con lo indicado hasta ahora es suficiente.
En el siguiente articulo (capitulo 2) veremos.
 en procesos de
maquinado de piezas con lo cual se agilizan las labores, incrementando la
seguridad y el rendimiento de las producciones en serie de los modelos de fabricación.
en procesos de
maquinado de piezas con lo cual se agilizan las labores, incrementando la
seguridad y el rendimiento de las producciones en serie de los modelos de fabricación.